Cell:生命的第一笔:受精触发的非对称性
来源:BioArt 2025-12-05 11:18
该研究为了解早期发育异质性和细胞命运偏向的分子起源提供了新视角,也为早期分子差异如何影响全能性和谱系分配奠定了基础,同时有助于通过指导胚胎选择提高发育存活率,从而优化辅助生殖技术。
在哺乳动物中,受精卵经历一系列卵裂分裂产生胚胎和胚胎外细胞。
在囊胚形成过程中发生两个连续的重要事件:第一,生成滋养外胚层(trophectoderm,TE)和内细胞团(inner cell mass,ICM);第二,ICM进一步分化为上胚层(epiblast)和原始内胚层(primitive endoderm,PE)。
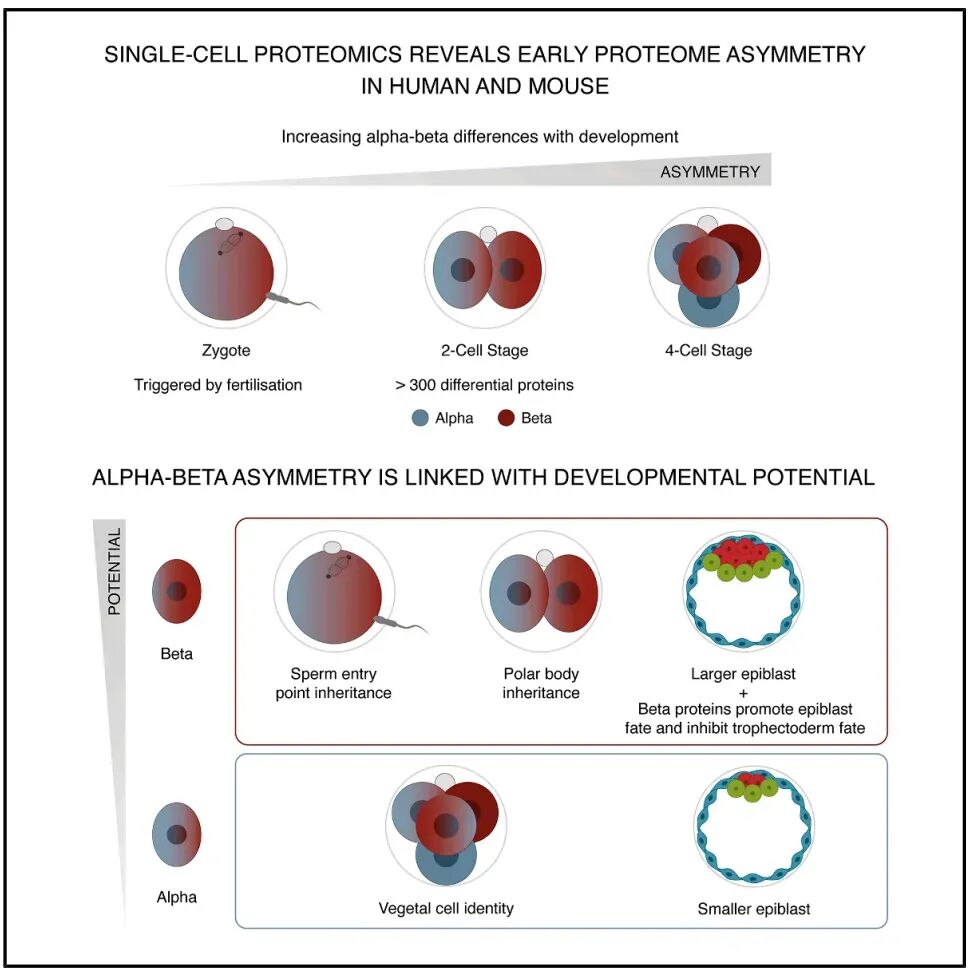
数十年来,普遍认为所有卵裂球在发育潜能上具有等效性-至少在16-细胞阶段之前具有同样的潜力发育为所有谱系。然而,这个观念逐渐受到挑战。目前越来越多的证据表明,全能性在谱系特化前就逐渐且不平等地在卵裂球中丧失【1】小鼠谱系追踪实验发现2-细胞胚胎的姐妹卵裂球对胚胎和胚胎外谱系的贡献存在差异【2】。此外,将2-细胞胚胎分割为单卵“半胚胎”后通常只有一个卵裂球能发育为存活胚胎【3】。
类似地,人类中也观察到这种不对称性:体细胞突变推断跨组织谱系的克隆分析表明,早期卵裂球对胚胎本身和胎盘的贡献并不均衡【1】;谱系追踪进一步证实,上胚层的大部分通常仅来源于2-细胞期的一个卵裂球,而两个卵裂球均参与胚外组织形成【2】。
尽管如此,这种早期不对称性的分子基础仍然不清楚。在黑腹果蝇等物种中,对称性打破由mRNA的不对称定位驱动,导致蛋白质分布不均和细胞命运分化【4】。在哺乳动物中,单细胞RNA测序已揭示卵裂球间存在转录组差异【5】。
然而,这种RNA水平的非对称性在不同胚胎间并非一致存在,且转录本丰度与蛋白质水平在不同组织或发育过程中也并非总是相关。因此,解析哺乳动物胚胎单个卵裂球间是否存在蛋白质组差异是必要的。
2025年12月3日,英国剑桥大学生理、发育与神经科学学系Magdalena Zernicka-Goetz团队在Cell杂志在线发表了题为Fertilization triggers early proteomic symmetrybreaking in mammalian embryos的研究文章。
该研究通过单细胞多重质谱技术分析小鼠和人类胚胎单个卵裂球的蛋白质组差异,首次揭示一种由受精作用引起的胚胎早期发育的蛋白质组非对称性且可以传递至子代卵裂球,并证实β亚型卵裂球具有更强的发育潜能,为理解胚胎全能性维持和早期谱系偏向提供了重要线索。

为了研究早期蛋白质组的非对称性,作者使用单细胞多重质谱技术(SCoPE2)在3种样本中检测蛋白质组学差异:早期2-细胞胚胎(合子基因组激活前);晚期2-细胞胚胎(合子基因组激活期间);4-细胞胚胎。聚类分析显示卵裂球明确分为两个稳定的聚类α型和β型。
在所有分析的2-细胞胚胎中均包括一个α亚型和一个β亚型卵裂球。每个卵裂球平均定量到1043种蛋白质中,差异分析显示349种在α和β亚型间丰度存在显著差异的蛋白质,例如Padi6、RNF114、Rdx 和 Cdc42。从早期到晚期2-细胞期再到4-细胞期,卵裂球间的蛋白质组差异幅度逐渐增大。
总之,团队首次在小鼠2-细胞期胚胎中发现姐妹卵裂球间蛋白质组不对称的证据。紧接着,作者进一步探究这种不对称是否起源于更早的受精卵阶段。为此,作者沿动物-植物极轴(第一次卵裂分裂最常见的方向)对小鼠受精卵进行人工经向二分。SCoPE2技术对受精卵半体进行分析发现受精卵半体可分为两个类似不同的聚类。
相关性分析表明聚类1的受精卵半体与α亚型卵裂球相似,聚类2与β亚型一致。这些结果表明蛋白质组不对称起源于受精卵阶段,并传递至2-细胞期。
随后,作者对早期和晚期2-细胞期样本进行蛋白质富集分析以揭示α和β亚型卵裂球的生物学过程差异。β亚型卵裂球富集蛋白质运输相关通路,如离子通道、信号组件、分子马达和囊泡运输,提示早期蛋白质组异质性可能与不同的发育轨迹相关。受精卵和早期2-细胞阶段胚胎依赖母源遗传成分,这核糖体组成差异会引起蛋白质翻译控制差异。
核糖体蛋白丰度分析显示大多数核糖体蛋白在α亚型卵裂球中的丰度略高于β亚型,提示两种亚型在翻译调控和蛋白质加工通路中存在差异。为探究α和β亚型卵裂球间这种蛋白质丰度差异的功能相关性,作者选取了三个候选蛋白:Nedd8(与内细胞团形成相关)、Gps1(与维持原始多能性和支持上胚层存活相关)和PSMC4(对胚胎发育至囊胚阶段至关重要)。
其中,Nedd8和Gps1在β亚型卵裂球中富集,而PSMC4在α亚型卵裂球中富集。dsRNA介导的敲低结合单个卵裂球注射和RFP标记技术证实Nedd8敲低引起滋养外胚层谱系增加,而对上胚层和原始内胚层无显著影响,提示Nedd8 可能具有抑制滋养外胚层特化或增殖的作用;Gps1敲低降低对上胚层贡献增加,对原始内胚层的影响较弱,对滋养外胚层无影响,提示Gps1支持上胚层的特化或增殖;PSMC4敲低导致总细胞数减少,且所有谱系均降低,提示PSMC4影响所有谱系发育。
总之,这些结果强调早期蛋白质组不对称在植入前发育中具有生物学功能意义。
随后,为了进一步评估α和β亚型的发育潜能,作者分离2-细胞期姐妹卵裂球,其中一个通过SCoPE2推断亚型,另一个培养至囊胚阶段。对所得囊胚的谱系组成分析显示β亚型卵裂球发育形成的囊胚上胚层细胞比例显著更高,而α亚型卵裂球形成的囊胚上胚层细胞更少。
此外,β亚型卵裂球更易发育为上胚层细胞数≥4的囊胚(胚胎进一步发育所需的最低阈值),提示β亚型卵裂球证实α-β亚型属性可以预测发育潜能:β亚型卵裂球形成的上胚层细胞更多,发育能力更强,而α亚型卵裂球则与发育潜能降低相关。
那么,这种胚胎发育早期的蛋白非对称性是受精引起还是母源遗传?
首先,作者通过质谱在孤雌胚胎的2-细胞期姐妹卵裂球无明确聚类模式且无稳定的蛋白质组不对称,表明母源因子不足以引起α和β亚型的产生。
其次,作者在体外受精后立即用微珠标记精子进入位点,随后以第二极体附着位点定义动物极,对受精卵进行经向二分,得到继承精子进入位点(微珠标记)和未继承该位点的两个半体行SCoPE2测序,发现受精锥阳性与阴性半体间的蛋白质组出现差异,且与2-细胞期姐妹卵裂球间的蛋白质组差异及α-β亚型属性显著相关,提示受精作用触发受精卵中的蛋白质组不对称,随后传递给子代卵裂球。
不仅如此,继承精子进入位点的卵裂球发育形成的囊胚上胚层细胞比例显著更高,这与β亚型卵裂球的发育偏向一致,进一步说明精子进入位点发育为β亚型卵裂球。
最后,团队发现人类2-细胞期胚胎的姐妹卵裂球同样可以稳定分为两个不同的聚类,且与小鼠的 α-β差异模式一致。这些结果表明姐妹卵裂球间的蛋白质组不对称是哺乳动物早期发育的保守特征。
综上所述,这项研究首次给出早期胚胎卵裂发育中蛋白质非对称的直接证据。哺乳动物卵母细胞在受精后出现蛋白质组的不对称并传递给子代形成α-β亚型卵裂球,其中β卵裂球具有更高的发育潜能。
该研究为了解早期发育异质性和细胞命运偏向的分子起源提供了新视角,也为早期分子差异如何影响全能性和谱系分配奠定了基础,同时有助于通过指导胚胎选择提高发育存活率,从而优化辅助生殖技术。
原文链接:
https://doi.org/10.1016/j.cell.2025.11.006
1. Qi, Chen., Junchao, Shi., Yi, Tao., Magdalena, Zernicka-Goetz.(2018). Tracing the origin of heterogeneity and symmetry breaking in the early mammalian embryo. Nat Commun, 9(1), 1819. doi:10.1038/s41467-018-04155-2
2. Sergi, Junyent., Maciej, Meglicki., Roman, Vetter., Rachel, Mandelbaum., Catherine, King., Ekta M, Patel., Lisa, Iwamoto-Stohl., Clare, Reynell., Dong-Yuan, Chen., Patrizia, Rubino., Nabil, Arrach., Richard J, Paulson., Dagmar, Iber., Magdalena, Zernicka-Goetz.(2024). The first two blastomeres contribute unequally to the human embryo. Cell, 187(11), 2838-2854.e17. doi:10.1016/j.cell.2024.04.029
3. E, Casser., S, Israel., A, Witten., K, Schulte., S, Schlatt., V, Nordhoff., M, Boiani.(2017). Totipotency segregates between the sister blastomeres of two-cell stage mouse embryos. Sci Rep, 7(1), 8299. doi:10.1038/s41598-017-08266-6
4. J, Kim-Ha., J L, Smith., P M, Macdonald.(1991). oskar mRNA is localized to the posterior pole of the Drosophila oocyte. Cell, 66(1), 23-35. doi:10.1016/0092-8674(91)90136-m
5. R Michael, Roberts., Mika, Katayama., Scott R, Magnuson., Michael T, Falduto., Karen E O, Torres.(2010). Transcript profiling of individual twin blastomeres derived by splitting two-cell stage murine embryos. Biol Reprod, 84(3), 487-94. doi:10.1095/biolreprod.110.086884
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


